W 0,6 dm3 wody rozpuszczono 30 g soli zawierającej 30% zanieczyszczeń. Oblicz stężenie procentowe roztworu (dwody = 1 g/cm3).
W 0,6 dm3 wody rozpuszczono 30 g soli zawierającej 30% zanieczyszczeń. Oblicz stężenie procentowe roztworu (dwody = 1 g/cm3). Wynik podaj z dokładnością do drugiego miejsca po
przecinku. Udziel poprawnej odpowiedzi.
Zaprojektuj sposób przygotowania 300g roztworu mrówczanu sodu o stężeniu 20%.
Zaprojektuj sposób przygotowania 300g roztworu mrówczanu sodu o stężeniu 20%. Wypisz kolejno po sobie następujące czynności przy projektowaniu.
Naturalne źródła węglowodorów to: ropa naftowa, gaz ziemny, nafta, węgiel kamienny, zabagnione tereny.
Oceń prawdziwość poniższych zdań. Wpisz do tabeli literę P, jeśli zdanie jest prawdziwe lub literę F, jeśli zdanie jest fałszywe.

Różnica elektroujemności atomów pierwiastków chemicznych w pewnych związkach chemicznych wynosi...
Różnica elektroujemności atomów pierwiastków chemicznych w pewnych związkach chemicznych wynosi:
a) 3,1
b) 1,4
c) 1,7
d) 0.
Ustal, jaki rodzaj wiązania występuje w tych substancjach i zapisz w poniższej tabeli:

aprojektuj doświadczenie chemiczne – Reakcja kwasu mrówkowego z alkoholem etylowym. Sformułuj problem badawczy w formie pytania do tego doświadczenia oraz przynajmniej jedną hipotezę do postawionego pytania.
Zaprojektuj doświadczenie chemiczne – Reakcja kwasu mrówkowego z alkoholem etylowym. Sformułuj problem badawczy w formie pytania do tego doświadczenia oraz przynajmniej jedną hipotezę do postawionego pytania. Narysuj schemat doświadczenia, uwzględnij jego warunki przebiegu, opisz je, zapisz obserwacje. Zapisz równanie reakcji chemicznej jaka miała miejsce w zaplanowanym doświadczeniu na wzorach półstrukturalnych lub strukturalnych, zaznaczając w kółeczku elementy, z których powstaje woda oraz zaznacz w kółeczku nowo powstałe wiązanie chemiczne oraz podaj jego nazwę. Zapisz wnioski podając nazwę reakcji chemicznej przebiegającej
zgodnie z projektem doświadczenia oraz nazwę zwyczajową i systematyczną nowo powstałego organicznego związku chemicznego.
W obu probówkach umieszczono dwa rodzaje tłuszczów: olej słonecznikowy i olej kokosowy. Jak odróżnisz oba te tłuszcze od siebie pod względem nasycenia?
W obu probówkach umieszczono dwa rodzaje tłuszczów: olej słonecznikowy i olej kokosowy. Jak odróżnisz oba te tłuszcze od siebie pod względem nasycenia?
Zapisz równania dysocjacji elektrolitycznej kwasu siarkowodorowego i węglowego w formie stopniowej.
Zapisz równania dysocjacji elektrolitycznej kwasu siarkowodorowego i węglowego w formie stopniowej.
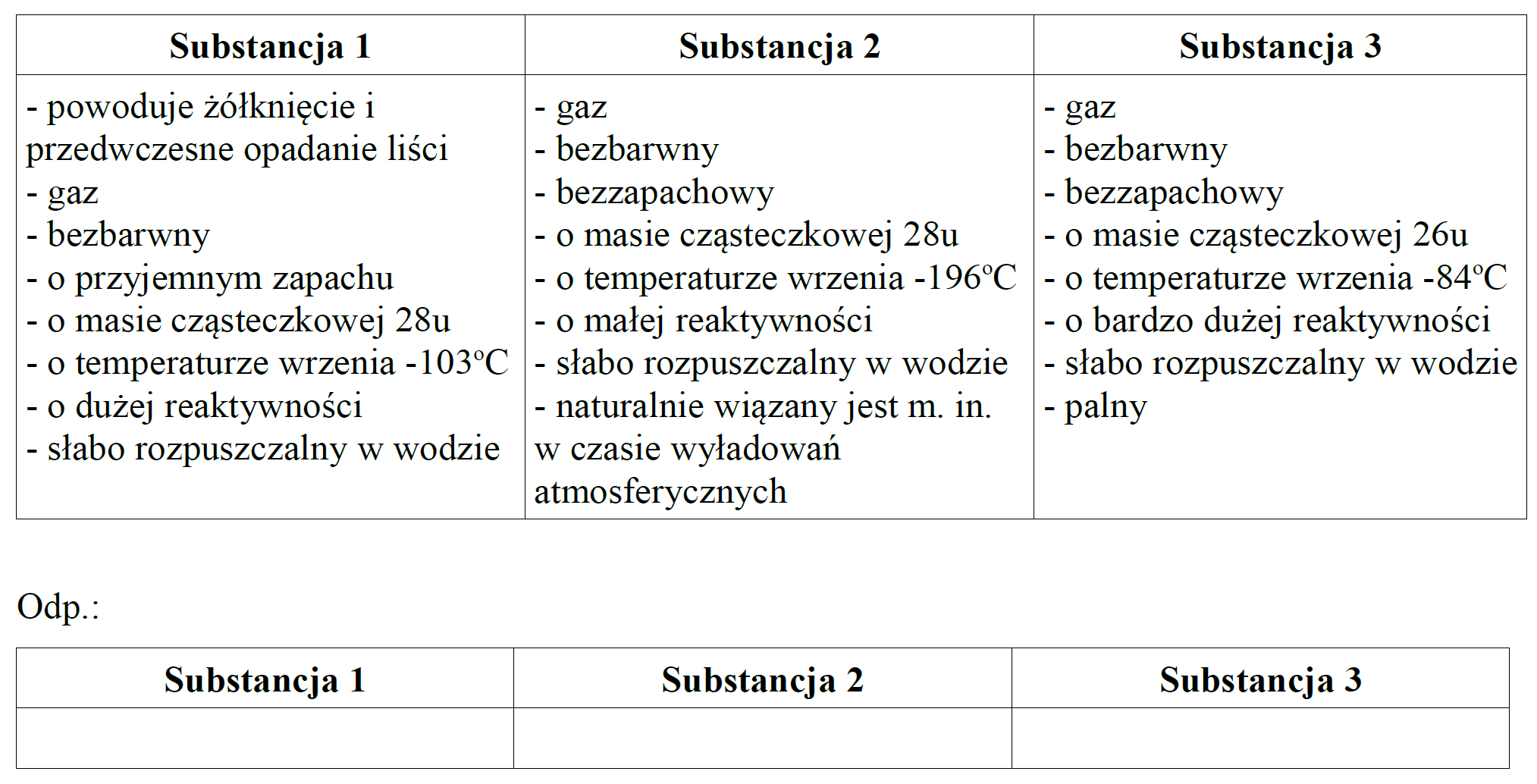
Przeanalizuj je i dopasuj odpowiednią substancję (azot, eten, etyn) do grupy właściwości, wpisując nazwy tych substancji do drugiej tabeli.
W poniższej tabeli zaprezentowano właściwości trzech substancji. Przeanalizuj je i dopasuj odpowiednią substancję (azot, eten, etyn) do grupy właściwości, wpisując nazwy tych substancji do drugiej tabeli.
Jaką rolę pełni katalizator w reakcjach chemicznych?
Jaką rolę pełni katalizator w reakcjach chemicznych?
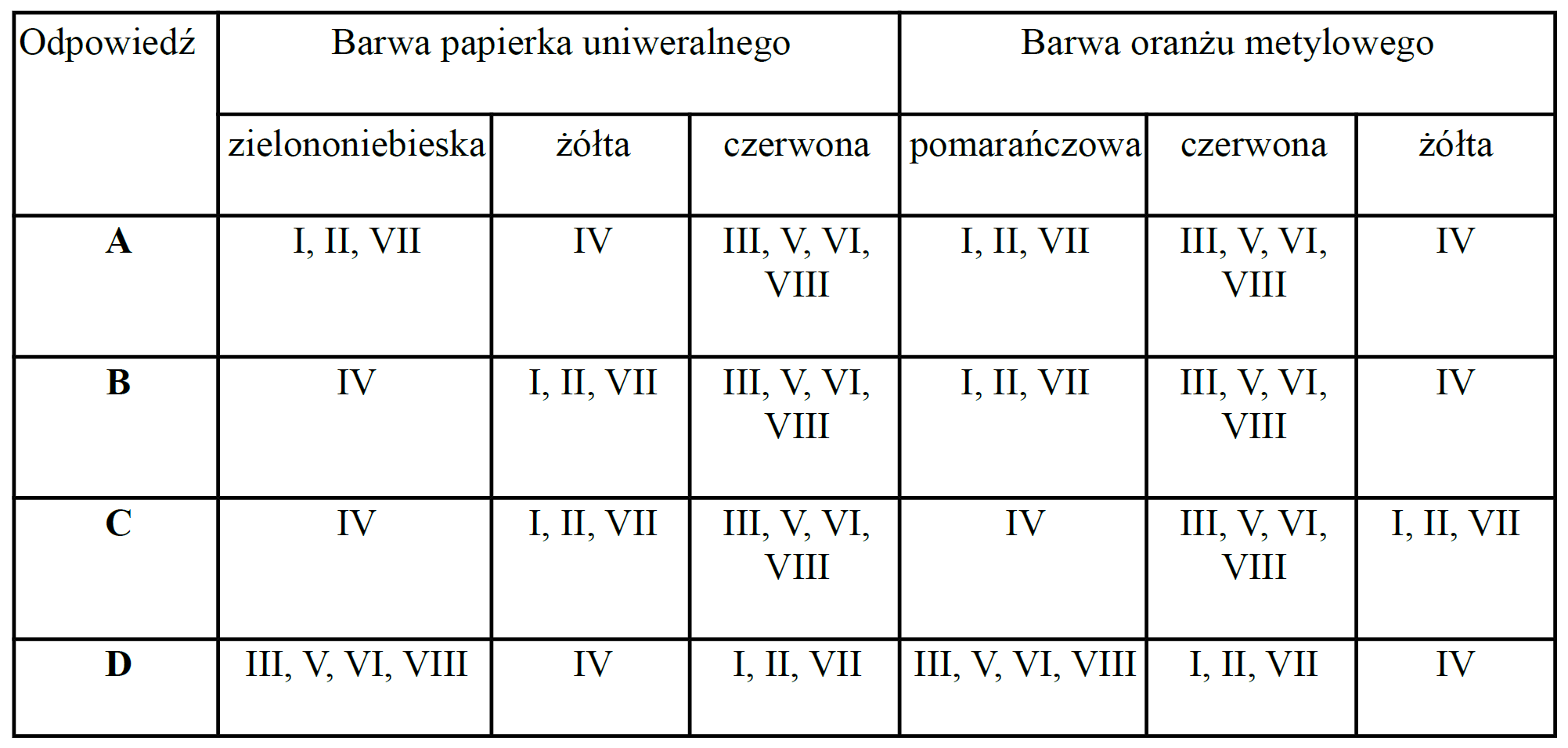
Odczyn badano dwoma wskaźnikami: papierkiem uniwersalnym i oranżem metylowym. Która odpowiedź przedstawia prawidłowe barwy wskaźników?
Do analizy odczynu poddano 8 probówek z przygotowanymi roztworami:
I – C6H12O6
II – NaCl
III – HCOOH
IV – proszek do rur kanalizacyjnych typu “Kret”
V – odkamieniacz do czajnika
VI – ocet
VII – glicerol
VIII – płyn z akumulatora
Odczyn badano dwoma wskaźnikami: papierkiem uniwersalnym i oranżem metylowym. Która odpowiedź przedstawia prawidłowe barwy wskaźników?
Wymień 8 właściwości polietylenu.
Wymień 8 właściwości polietylenu.
Jaki to pierwiastek, którego atom ma taką samą liczbę elektronów, jak jony...
Jaki to pierwiastek, którego atom ma taką samą liczbę elektronów, jak jony:
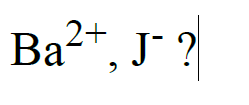
Zapisz równania odpowiednich reakcji chemicznych dwóch najgroźniejszych kwasów występujących w kwaśnych deszczach z głównym składnikiem muszli ślimaków.
Ślimaki żyją w środowisku, którego pH>6. Muszle ślimaków zawierające węglan wapnia są bardzo wrażliwe na kwaśny odczyn środowiska. Zapisz równania odpowiednich reakcji chemicznych
dwóch najgroźniejszych kwasów występujących w kwaśnych deszczach z głównym składnikiem muszli ślimaków. (Cząsteczka jednego kwasu zbudowana jest z 5 atomów, a cząsteczka drugiego
kwasu zbudowana jest z 7 atomów).
Co mogło być przyczyną, że gaz spalał się niecałkowicie? Napisz wszystkie możliwe równania reakcji spalania niecałkowitego głównego składnika gazu ziemnego.
W łazience, gdzie umieszczony jest piec gazowy z wykorzystaniem gazu ziemnego, który po włączeniu podgrzewa wodę, stwierdzono obecność tlenku węgla (II). Co mogło być przyczyną, że gaz spalał się niecałkowicie? Napisz wszystkie możliwe równania reakcji spalania niecałkowitego głównego składnika gazu ziemnego.
